Quando gli utenti caricano (e classificano) documenti su Study eBinder o classificano documenti esistenti non classificati in Study eBinder, il sistema verifica automaticamente la corrispondenza tra i documenti esistenti, riducendo la probabilità di caricare file duplicati nel tuo eISF. Ciò garantisce anche un processo di versioning più allineato tra tutti gli utenti.
- I controlli vengono eseguiti solo quando un utente carica (e classifica) un documento in Study eBinder o classifica un documento esistente non classificato in Study eBinder.
- Non vengono eseguiti controlli durante la creazione di un documento nella Libreria.
- Non vengono effettuati controlli quando si carica un documento non classificato nella Posta in arrivo dei documenti di Study eBinder.
- I controlli non vengono effettuati sui seguenti tipi di documenti Sede: Promemoria sulla politica, Procedure operative standard, Istruzioni di lavoro.
Esistono due tipi di controlli duplicati: controllo file duplicati e controllo tipo documento duplicato.
Controllo file duplicati
SiteVault verificherà se il file sorgente caricato corrisponde esattamente al file sorgente di un documento esistente. Se viene rilevata una corrispondenza, verrà visualizzato un avviso che informa dell'avvenuta corrispondenza e offre la possibilità di annullare o procedere con il caricamento. Questo controllo viene eseguito su tutti i tipi di documenti eISF.
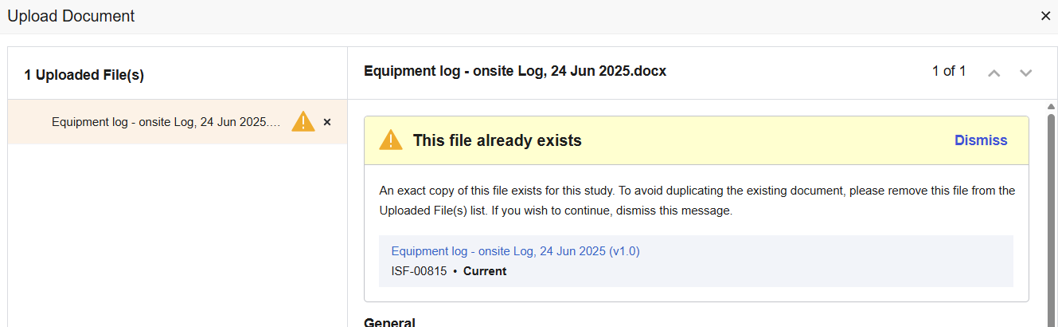
Controllo del tipo di documento duplicato
SiteVault verificherà se i campi del documento compilati dall'utente (o i metadati) corrispondono a un documento esistente. Se viene rilevata una corrispondenza, verrà visualizzato un avviso che informa dell'avvenuta corrispondenza e offre la possibilità di aggiornare il documento esistente, annullare il caricamento del documento o caricarlo come nuovo documento separato. Questo controllo viene eseguito solo su tipi di documento specifici (vedere di seguito).
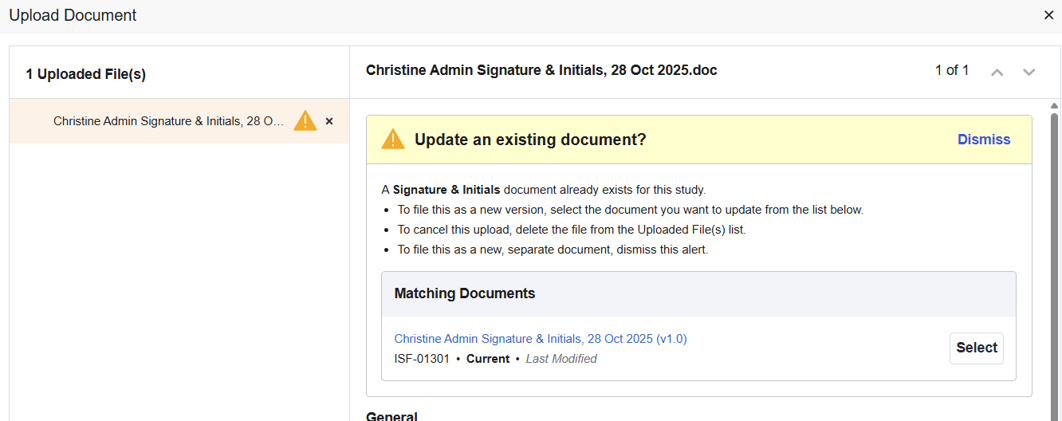
Documenti abilitati con il controllo del tipo di documento duplicato
- 1572 o equivalente
- CV
- Delega di autorità
- Modulo di consenso informato (vuoto)
- Opuscolo per gli investigatori
- Conformità IRB/IEC
- Composizione IRB/IEC
- Certificazione di laboratorio
- Registro delle visite di monitoraggio
- Licenza medica
- Registro di iscrizione dei partecipanti
- Protocollo
- Firma e iniziali
- Evidenza formativa (non specifica dello studio)